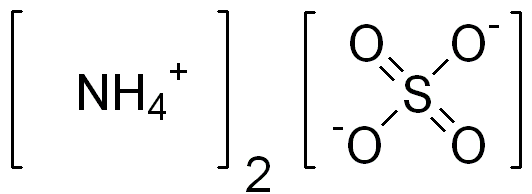با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد

تضمین کیفیت و اصالت کالا
ارسال سریع به سراسر کشور
بازگشت کالا به دلیل "انصراف از خرید" در صورتی مورد قبول است که پلمپ کالا باز نشده باشد.
معرفی آمونیوم سولفات
آمونیوم سولفات ((NH4)2SO4) نمکی معدنی با کاربردهای فراوان، به ویژه در صنعت کشاورزی است. این ماده به عنوان یک منبع غنی از نیتروژن (21 درصد) و گوگرد (24 درصد) شناخته میشود و نقشی حیاتی در تغذیه گیاهان ایفا میکند.آمونیوم سولفات ترکیب غیرآلی است که به صورت کریستالهای بیرنگ و بیبو وجود دارد. این ماده بخوبی در آب حل میشود اما در اتانول و استون نامحلول است.این نمک غیرآلی است که از دو یون آمونیوم و یک یون سولفات تشکیل شده است.کاربردهای اصلی آن شامل استفاده به عنوان کود در کشاورزی، تنظیمکننده pH در صنایع غذایی، و عامل منعقدکننده در تصفیه آب میباشد.
آمونیوم سولفات برای اولین بار در قرن 16 به عنوان محصول فرعی در تولید الکل به دست آمد. در اوایل قرن 20، تولید صنعتی آمونیوم سولفات به عنوان کود شیمیایی آغاز شد.معمولا به عنوان منبع نیتروژن و گوگرد در کودهای شیمیایی استفاده میشود. آمونیوم سولفات به دلیل ویژگیهای کشاورزی مفیدش، به خصوص در خاکهایی که نیاز به گوگرد دارند، یک انتخاب محبوب است.آمونیوم سولفات را میتوان به صورت قبل از کاشت، حین کاشت و یا بعد از کاشت به خاک اضافه کرد.
تاریخچه آمونیوم سولفات
تاریخچه کشف آمونیوم سولفات به دوران قبل از قرن 20 برمیگردد، اما مستندات دقیق و کاملی در مورد اولین کشف آن وجود ندارد. با این حال، میتوان این ماده را به عنوان یکی از موادی دانست که در اوایل توسعه صنعتی شیمیایی، مورد توجه قرار گرفت. آمونیوم سولفات در ابتدا به عنوان محصول جانبی در تولید صنعتی اسید نیتریک به دست میآمد. همچنین، در فرآیندهایی که شامل استفاده از آمونیاک بود، تولید میشد.
با وجود اینکه زمان دقیق کشف اولیه آمونیوم سولفات نامشخص است، نقش آن در پیشبرد کشاورزی مدرن و صنایع شیمیایی بسیار برجسته است. این ماده یکی از نمونههای کلیدی در تاریخ شیمی محسوب میشود که نشاندهنده تأثیر علم بر پیشرفت صنعتی و کشاورزی است.
روش تولید آمونیوم سولفات
آمونیوم سولفات (NH₄)₂SO₄ یک ماده شیمیایی است که از ترکیب آمونیاک (NH₃) و اسید سولفوریک (H₂SO₄) تولید میشود. دو روش اصلی برای تولید آمونیوم سولفات وجود دارد:
1. فرآیند هابر-بوش:
این رایج ترین روش تولید آمونیوم سولفات است. در این روش، گاز آمونیاک (NH3) و گاز دی اکسید گوگرد (SO2) با یکدیگر واکنش می دهند و آمونیوم سولفات (NH4)2SO4 و آب (H2O) تولید می کنند:
2NH3 + SO2 + H2O → (NH4)2SO4 + H2O
این واکنش در شرایط فشار و دمای بالا و با استفاده از کاتالیزور انجام می شود.
2. خنثی سازی اسید سولفوریک با آمونیاک:
در این روش، اسید سولفوریک (H2SO4) با آمونیاک (NH3) واکنش می دهد و آمونیوم سولفات (NH4)2SO4 و آب (H2O) تولید می کنند:
H2SO4 + 2NH3 → (NH4)2SO4 + H2O
این واکنش به طور معمول در محلول آبی انجام می شود.
ساختار آمونیوم سولفات
آمونیوم سولفات ((NH4)2SO4) یک ترکیب معدنی با ساختار بلوری مکعبی است. در این ساختار، کاتیون آمونیوم (NH4+) و آنیون سولفات (SO42-) به طور متناوب در کنار یکدیگر قرار گرفته اند.
کاتیون آمونیوم:
کاتیون آمونیوم از یک اتم نیتروژن و چهار اتم هیدروژن تشکیل شده است. اتم نیتروژن با پیوند یگانه به هر اتم هیدروژن متصل شده است. اتم نیتروژن دارای بار مثبت 1+ است.
آنیون سولفات:
آنیون سولفات از یک اتم گوگرد و چهار اتم اکسیژن تشکیل شده است. اتم گوگرد در مرکز تتراهدری قرار گرفته و هر اتم اکسیژن در یکی از راس های آن قرار دارد. اتم گوگرد با پیوند یگانه به هر اتم اکسیژن متصل شده است. اتم گوگرد دارای بار منفی 6- و هر اتم اکسیژن دارای بار منفی 2- است.
ساختار آمونیوم سولفات به صورت زیر است:
جدول مشخصات آمونیوم سولفات
نام | فرمول شیمیایی | جرم مولی | شکل ظاهری | نقطه ذوب | نقطه جوش | حلالیت | چگالی | pH |
|---|---|---|---|---|---|---|---|---|
آمونیوم سولفات | (NH4)2SO4 | 132.14 گرم بر مول | جامد بلوری بی رنگ | 205 درجه سانتیگراد | 337.5 درجه سانتیگراد | محلول در آب (706 گرم در لیتر در 20 درجه سانتیگراد) | 1.77 گرم بر سانتی متر مکعب | 5.5 (محلول 10% آبی) |
کاربرد آمونیوم سولفات
آمونیوم سولفات ((NH₄)₂SO₄) دارای کاربردهای متنوعی در صنایع مختلف است. در اینجا برخی از اصلیترین کاربردهای آن ذکر شده است:
- کود کشاورزی:
آمونیوم سولفات یکی از مهمترین منابع تغذیهای نیتروژن برای گیاهان است. این کود شیمیایی به دلیل ارائه نیتروژن به شکل آمونیوم، که به راحتی توسط گیاهان جذب میشود، بسیار محبوب است.
همچنین، این کود به تنظیم اسیدیته خاک کمک میکند که برای بسیاری از محصولات کشاورزی مطلوب است. - صنایع شیمیایی:
آمونیوم سولفات به عنوان عامل پخش کننده در تهیه مواد شیمیایی مورد استفاده قرار میگیرد.
به عنوان کاتالیزور در تولید رزینها و پلاستیکها. - تصفیه آب:
استفاده به عنوان یک فلوکولانت در تصفیه آب و پساب برای کمک به تهنشینی ذرات معلق. - صنایع غذایی:
به عنوان جزء افزودنیهای غذایی، برای تنظیم اسیدیته و به عنوان عامل جداکننده. - صنعت داروسازی:
در تولید واکسنها و دیگر محصولات بیولوژیکی به عنوان یک تثبیت کننده. - صنایع نساجی:
به عنوان عامل ثابت کننده رنگها در صنعت نساجی. - صنایع آتشبازی:
آمونیوم سولفات به عنوان ماده اکسیدکننده در تولید آتشبازی استفاده میشود. - محافظت از محیط زیست:
به کار رفتن در مبارزه با آتش جنگلها و علفهای هرز.
آمونیوم سولفات به دلیل ویژگیهای خاص خود، یکی از پرکاربردترین مواد شیمیایی در بسیاری از زمینهها به شمار میرود.
خطرات آمونیوم سولفات
آمونیوم سولفات به طور کلی یک ترکیب شیمیایی نسبتاً بیخطر است، اما مانند هر ماده شیمیایی دیگری، استفاده نادرست از آن میتواند خطراتی را به دنبال داشته باشد. در اینجا برخی از خطرات احتمالی آمونیوم سولفات ذکر شده است:
- تحریک پذیری:
تماس مستقیم با پوست یا چشمها میتواند باعث تحریک شود. در صورت تماس طولانی مدت، این تحریک ممکن است منجر به التهاب یا سوزش شود. - خطرات تنفسی:
استنشاق گرد و غبار آمونیوم سولفات میتواند منجر به تحریک دستگاه تنفسی شود. در محیطهایی که غبار زیادی وجود دارد، استفاده از ماسک مناسب توصیه میشود. - خطرات زیست محیطی:
آمونیوم سولفات در آب به راحتی حل میشود، اما ورود بیش از حد این ماده به سیستمهای آبی میتواند منجر به افزایش میزان نیتروژن شود که پدیده ایوتروفیکاسیون را تسریع کرده و بر زندگی آبزیان تاثیر منفی میگذارد. - سمیت:
در حالی که آمونیوم سولفات به طور کلی به عنوان ماده سمی شناخته نمیشود، مصرف خوراکی بیش از حد آن میتواند باعث اختلالات گوارشی، ناراحتی معده و سایر مشکلات سلامتی شود. - ترکیب با مواد دیگر:
ترکیب آمونیوم سولفات با مواد شیمیایی خاص (مانند سفید کنندهها و اکسیدکنندههای قوی) میتواند واکنشهای خطرناک ایجاد کند.
برای کاهش خطرات ناشی از استفاده از آمونیوم سولفات، استفاده از تجهیزات حفاظتی مناسب، مانند دستکش، عینک ایمنی، و ماسک تنفسی توصیه میشود، و همچنین باید دستورالعملهای ایمنی محل کار را به دقت رعایت کرد.
نحوه دفع آمونیوم سولفات
دفع آمونیوم سولفات باید به گونهای انجام شود که به محیط زیست آسیب نرساند و با قوانین محلی مطابقت داشته باشد. در اینجا چند نکته کلیدی برای دفع صحیح آمونیوم سولفات آورده شده است:
- بررسی مقررات محلی
قبل از دفع آمونیوم سولفات، باید با قوانین و مقررات محلی در مورد دفع مواد شیمیایی آشنا شوید. این مواد ممکن است باید به عنوان مواد خطرناک یا غیرخطرناک دستهبندی و مطابق با دستورالعملهای خاص دفع شوند. - استفاده از مراکز دفع مجاز
آمونیوم سولفات باید به مرکز دفع مواد شیمیایی مجاز تحویل داده شود. این مراکز تجهیزات و روشهای مناسب برای دفع ایمن این نوع مواد را دارند. - بازیافت
اگر امکانپذیر باشد، بازیافت آمونیوم سولفات را در نظر بگیرید. برخی صنایع ممکن است قادر به استفاده مجدد از آمونیوم سولفات به عنوان منبع مواد اولیه باشند. - رقیقسازی
در صورتی که آمونیوم سولفات در مقادیر کم دفع میشود، میتوان آن را با آب زیادی رقیق کرد تا از تمرکز بالا و ایجاد خطرات زیست محیطی جلوگیری شود، مخصوصاً در مواردی که این کار با قوانین محلی مغایرت ندارد. - امحاء
برای مقادیر بسیار زیاد آمونیوم سولفات که نمیتوان آنها را بازیافت یا به کار دیگری اختصاص داد، باید با دقت و تحت نظارت از بین برده شوند تا هیچ تأثیر منفی بر محیط زیست نداشته باشند.
همیشه توصیه میشود که پیش از دفع مواد شیمیایی، به دنبال راهنماییهای حرفهای باشید و با مقامات محلی یا شرکتهای مدیریت پسماند تماس بگیرید تا از دفع ایمن و مطابق با قوانین اطمینان حاصل کنید.
نگهداری و بستهبندی آمونیوم سولفات
نگهداری و بستهبندی آمونیوم سولفات به صورتی که ایمنی و پایداری آن تضمین شود، اهمیت بسزایی دارد. در ادامه راهنماییهای کلیدی در این زمینه آورده شده است:
بستهبندی
- مواد بستهبندی: آمونیوم سولفات باید در بستهبندیهای محکم و مقاوم در برابر رطوبت نگهداری شود. این ماده معمولاً در کیسههای پلاستیکی ضخیم یا کیسههای پلیپروپیلن بستهبندی میشود.
- مهر و موم: کیسهها باید به خوبی مهر و موم شوند تا از نفوذ رطوبت و دیگر عوامل محیطی جلوگیری شود که میتواند به محصول آسیب برساند.
نگهداری
- شرایط محیطی: آمونیوم سولفات باید در محیطی خشک و خنک نگهداری شود. رطوبت میتواند باعث تجمع و سخت شدن ماده شود، پس از نگهداری در محیطهای مرطوب باید پرهیز شود.
- جداسازی از مواد دیگر: باید از نگهداری آمونیوم سولفات در نزدیکی مواد قابل اشتعال یا مواد شیمیایی سازگار ناسازگار، مانند اسیدها و مواد اکسیدکننده، خودداری کرد.
- دسترسی محدود: دسترسی به محل نگهداری آمونیوم سولفات باید محدود و تنها به کارکنان آموزش دیده و مجاز محدود شود تا از سوء استفاده یا استفاده نادرست جلوگیری شود.
- علامتگذاری و اطلاعات ایمنی: بستهبندی آمونیوم سولفات باید به طور واضح با اطلاعات ایمنی مربوط به مواد و هشدارهای لازم علامتگذاری شود.
- بررسی دورهای: موجودی آمونیوم سولفات باید به طور منظم برای تشخیص هر گونه نشتی، تجمع یا آسیب دیدگی بررسی شود.
با رعایت این اصول، میتوان از آمونیوم سولفات به صورت ایمن نگهداری کرد و از بروز مشکلات جلوگیری نمود.
فروش آمونیوم سولفات
فروشگاه ای آز فعال در حوزه فروش اینترنتی مواد شیمیایی آزمایشگاهی و صنعتی و لوازم و تجهیزات آزمایشگاهی است که آماده فروش آمونیوم سولفات در بسته بندی های مقرون به صرفه و با کیفیت ممتاز در گریدهای صنعتی و آزمایشگاهی و از برندهای معتبر ایرانی، هندی، چینی و اروپایی به پژوهشگران، دانشگاهیان، صنایع و کارخانجات است.
خرید آمونیوم سولفات دکتر مجللی
کاربر موظف است پیش از اقدام به خرید این کالا، صفحه قوانین و مقررات وبسایت را مطالعه کند. جهت خرید آمونیوم سولفات می توانید از بخش "افزودن به سبد خرید" اقدام به ثبت سفارش کالای مورد نظر در وبسایت کنید. از طریق پیامک، واتس اپ، ایتا و روبیکا با شماره 09925021003 نیز می توانید کالای مورد نظر را مستقیما از شرکت خریداری کنید.
نحوه انبار کردن آمونیوم سولفات چگونه است؟
باید در محل خشک و دور از رطوبت نگهداری شود تا از تجمع آن جلوگیری شود. همچنین باید در بستهبندیهای محکم و بسته بماند تا از ورود آلودگیها و رطوبت جلوگیری شود.
آمونیوم سولفات چه تأثیری بر خاک دارد؟
استفاده بیش از حد از آمونیوم سولفات میتواند باعث اسیدی شدن خاک شود، که نیاز به اصلاح خاک دارد تا از تأثیرات منفی بر رشد گیاهان جلوگیری شود.
آمونیوم سولفات به چه شکلهایی در بازار موجود است؟
آمونیوم سولفات معمولاً به صورت کریستالهای سفید رنگ یا به شکل پودری عرضه میشود. برخی از انواع میکروگرانوله آن نیز برای استفاده آسانتر در کشاورزی موجود است.
چه تدابیر ایمنی باید هنگام کار با آمونیوم سولفات رعایت شود؟
باید از دستکش، ماسک و عینک محافظ استفاده کرد تا از تماس مستقیم با پوست و تنفس آن جلوگیری شود. همچنین باید محل کار را خوب تهویه کرد تا از تجمع بخارات اجتناب شود.
آمونیوم سولفات چگونه بر محیط زیست تأثیر میگذارد؟
هرچند آمونیوم سولفات به خودی خود به عنوان یک ماده آلاینده شناخته نمیشود، اما استفاده بیرویه و زیاد از آن میتواند به رواناب نیتروژن در محیط زیست منجر شود، که این امر میتواند باعث ایجاد پدیدهای به نام ائوتروفیکاسیون در آبهای سطحی شود.
آیا آمونیوم سولفات برای گیاهان خاصی توصیه میشود؟
آمونیوم سولفات به ویژه برای گیاهانی که نیاز به نیتروژن بالا دارند و در خاکهایی که pH بالا دارند مفید است، زیرا این کود به اسیدی شدن خاک کمک کرده و محیط مناسبتری برای جذب مواد مغذی فراهم میکند.
 آمونیوم سولفات (دکتر مجللی)
آمونیوم سولفات (دکتر مجللی)