با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
سدیم هیدروکسید پرک (سود پرک) (دکتر مجللی) Sodium Hydroxide Flakes (Extra pure)
نام های مترادف:کاستیک سودا، سود سوز آور و سود کاستیک
ارسال سریع به سراسر کشور
تضمین کیفیت کالا
بازگشت کالا به دلیل "انصراف از خرید" در صورتی مورد قبول است که پلمپ کالا باز نشده باشد.
معرفی و کاربرد سدیم هیدروکسید پرک
NaOH یا کاستیک سودا یا سود سوز آور، ماده ای معدنی است که از آن برای کنترل pH و ایفای نقش بافر در تهیه بسیاری از مواد همچون محصولات آرایشی و بهداشتی استفاده می کنند. این قلیای قوی در دمای اتاق جامدی کریستالی سفید و بدون بو است. در گذشته سدیم هیدروکسید در صابون استفاده می شد و امروزه نیز در فرمول ساخت بسیاری از مواد وجود دارد. به عنوان ماده ای مجاز برای افزودن مستقیم به غذا ( با گرید خوراکی E524) شناخته می شود. دو شکل رایج این ماده به صورت جامد پرک و گرانول می باشد.
یکی از کاربردهای سدیم هیدروکسید اسکراب گاز به منظور حذف اسیدهای مخلوط در آن قبل از تزریق به محیط بازمی باشداز جمله این قبیل گازها می توان به گازهای حاصل از سوختن سوخت های فسیلی که حاوی مقدار قابل توجهی از دی اکسید گوگردهستند اشاره نمود. متدهای بسیاری جهت به دام انداختن گاز دی اکسید گوگرد وجود دارند. یکی از شناخته شده ترین این متدها که بصورت گسترده مورد استفاده قرار دارد، اسکراب گازهای مخلوط در محلول سدیم و کلسیم هیدروکسید می باشد. این متد در فرایندهای پالایشی متنوع مانند تصفیه بوکسیت استفاده می شود.
یکی دیگر از کاربردهای اصلی سدیم هیدروکسید در پروسه تولید کاغذ از چوب می باشد. این پروسه شامل متدهای متفاتی از جمله متد "کرافت" بوده که در متد مذکور چوب را با یک محلول حاوی مخلوطی از سولفید سدیم و هیدروکسید سدیم پالایش و پاکسازی می شود: از جمله این محصولات نامطلوب می توان به لیگنین، روغنهای نامحلول و سلولز خالص برگ ها اشاره نمود. سلولز پس از خالص سازی اولیه در این متد، همچنین طی فراوریهای مراحل بعدی، به اصلی ترین محصول جهت تولید کاغذ تبدیل می گردد. سایر کاربردهای سدیم هیدروکسید عبارتند از: تولید محصولات فعال سطحی (سورفکتانتها )، صابون و سفید کننده ها. شکل ظاهری سدیم هیدروکسید، سود پرک در شکل زیر ارائه شده است.

تاریخچه سدیم هیدروکسید
تاریخچه تولید سدیم هیدروکسید به قرن ها قبل برمی گردد. اولین اشاره به این ماده در کتاب “المخترع فی فنون من الصنع” نوشته محمد زکریای رازی، دانشمند ایرانی قرن یازدهم میلادی، یافت شده است. رازی روشی برای تولید سدیم هیدروکسید از خاکستر گیاهان حاوی سدیم مانند علف شور ابداع کرد.در قرن هفدهم میلادی، صابون سازان اروپایی از سدیم هیدروکسید برای تولید صابون استفاده می کردند. آنها این ماده را با جوشاندن خاکستر گیاهان حاوی سدیم با آب تولید می کردند.در قرن نوزدهم میلادی، فرآیندهای صنعتی برای تولید سدیم هیدروکسید توسعه یافت. در سال 1888، روش الکترولیز نمک خوراکی برای تولید سدیم هیدروکسید ابداع شد. این روش امروزه متداول ترین روش تولید سدیم هیدروکسید است.
ساختار سدیم هیدروکسید
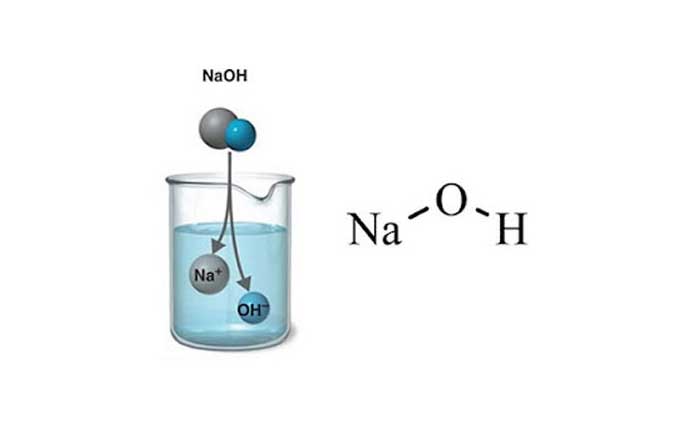
سدیم هیدروکسید با فرمول شیمیایی NaOH یک ترکیب یونی متشکل از کاتیون سدیم (Na+) و آنیون هیدروکسید (OH-) است.پیوند بین یونهای سدیم و هیدروکسید در سدیم هیدروکسید، پیوند یونی است.در پیوند یونی، اتمها با تبادل الکترون و تبدیل شدن به یونهای با بار مخالف، به یکدیگر متصل میشوند.
در سدیم هیدروکسید، اتم سدیم یک الکترون از دست میدهد و به کاتیون Na+ تبدیل میشود.اتم هیدروکسید یک الکترون اضافی دریافت میکند و به آنیون OH- تبدیل میشود.جاذبه الکترواستاتیکی بین کاتیونهای Na+ و آنیونهای OH-، پیوند یونی را تشکیل میدهد.
روش تولید سدیم هیدروکسید
تولید هیدروکسید سدیم به دو روش انجام می شود:
- 1.روش الکترولیز:این روش متداول ترین روش تولید هیدروکسید سدیم است. در این روش، محلول اشباع شده سدیم کلرید (NaCl) را در یک سلول الکترولیز قرار می دهند. جریان الکتریکی از طریق محلول عبور می کند و باعث می شود که سدیم کلرید به سدیم هیدروکسید و کلر تجزیه شود.معادله واکنش الکترولیز سدیم کلرید به شرح زیر است:
2NaCl → 2Na + Cl2
Na2O + H2O → 2NaOH
- 2.روش سوزاندن سدیم کربنات:در این روش، سدیم کربنات (Na2CO3) را در دمای بالا می سوزانند. در این فرآیند، سدیم کربنات به سدیم اکسید (Na2O) و دی اکسید کربن (CO2) تجزیه می شود. سپس، سدیم اکسید را با آب واکنش می دهند تا سدیم هیدروکسید تولید شود.معادله واکنش سوزاندن سدیم کربنات به شرح زیر است:
2Na2CO3 → Na2O + CO2
Na2O + H2O → 2NaOH
اسامی متداول سدیم هیدروکسید پرک
سدیم هیدروکسید با نام های متعددی شناخته می شود که برخی از رایج ترین آنها عبارتند از:
- سود سوزآور
- هیدروکسید سدیم
- سود کاستیک
- لی سود
- سود پرک
- آهک سودا
ویژگی فیزیکی و شیمیایی سدیم هیدروکسید پرک
| ساختار | 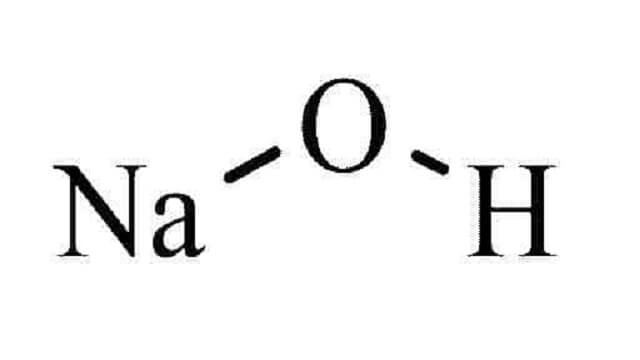 |
| فرمول مولکولی | NaOH |
| cas no | 1310-73-2 |
| جرم مولکولی | 39.99 g/mol |
| شکل ظاهری | بلورهای سفید، سخت، مات |
| چگالی | 2.13 g//ml |
| نقطه ذوب | 323ºC |
| نقطه جوش | 1388ºC |
| ویسکوزیته | 78 mpa/s |
| حلالیت | گلیسیرین، آب،تانولا،متانول |
کاربرد سدیم هیدروکسید پرک
- صنایع رنگرزی
- تولید کارتن و کاغذ
- صنایع چرم و نساجی
- صنایع نفت و گاز و پترو شیمی
- خنثیسازی اسید و باتری سازی
- چربی گیرها و سایر صنایع وابسته
- صنایع غذائی، صنایع شیر، کنسرو سازی
- نوشابه سازی، کارخانه قند و شکر، کارخانه روغن
- صنایع دارو سازی، الکلسازی و آرایشی و بهداشتی
- صنایع فلزی و تولید شیشه روی، آلومینیوم، گالوانیزه و آبکاری
- صنعت نفت و گاز
- صنایع نظامی
- صنعت پلیمر و پت
انبار و جابجایی سدیم هیدروکسید پرک
محل انبار باید خشک، خنک و دارای تهویه مناسب باشد.همچنین باید دور از منابع گرما و آتش باشد.سعی کنید محل نگهداری سدیم هیدروکسید دور از مواد شیمیایی اسیدی باشد.
هنگام جابجایی سدیم هیدروکسید باید از تجهیزات ایمنی مناسب مانند دستکش، عینک و لباس محافظ استفاده کرد.تجهیزات ایمنی باید سالم و بدون نقص باشند.سدیم هیدروکسید باید با احتیاط و به آرامی جابجا شود.از ضربه زدن به ظروف حاوی سدیم هیدروکسید خودداری کنید.از ریختن سدیم هیدروکسید بر روی زمین خودداری کنید.
دفع ضایعات سدیم هیدروکسید پرک
سدیم هیدروکسید که به عنوان سود سوزآور نیز شناخته می شود، یک ماده شیمیایی قلیایی قوی است. دفع ضایعات سدیم هیدروکسید باید با احتیاط و به روشی صحیح انجام شود تا از خطرات احتمالی برای سلامتی انسان و محیط زیست جلوگیری شود.دفع ضایعات سدیم هیدروکسید باید مطابق با مقررات محلی و ملی مربوط به دفع مواد شیمیایی خطرناک انجام شود.روش های دفع ضایعات سدیم هیدروکسید:خنثی سازی،رقیق سازی،تصفیه فاضلاب،سوزاندن
نکات ایمنی کار با سدیم هیدروکسید
این ماده را در جای خشک و خنک نگهداری نمایید. بشکه های حاوی این ترکیب بعد از خالی شدن نیز می توانند خطرناک باشند. به دلیل جذب بالای کربن دی اکسید هوا توسط این ترکیب آن را در ظروف مقاوم به هوا نگهداری می نمایند. سدیم هیدروکسید به راحتی با چربی ها و روغن موجود بر روی پوست وارد واکنش می شود تا بتواند نمک تولید نماید. بنابراین این ماده بسیار خطرناک است و بعد از تماس با این ترکیب باید فورا محل آلوده شده را شست و شو داد. محلول های 0.5 مولار از این ماده باید با نام خورنده لیبل گذاری شوند و محلول های با غلظت 0.5–0.05 مولار می توانند منجر به حساسیت و تحریک پوست گردند. خریدار موظف است کلیه دستورالعمل های استعمال مربوطه را مطالعه و با اطلاع کافی آن را خریداری کند. پوشیدن دستکش، ماسک و عینک آزمایشگاهی الزامیست. از بلیعدن، تماس با پوست و استنشاق خودداری کنید.
اثرات مواجهه کوتاه مدت سدیم هیدروکسید
مواجهه کوتاه مدت با سدیم هیدروکسید می تواند اثرات مضری بر سلامتی انسان داشته باشد. این اثرات به میزان و نحوه مواجهه و غلظت سدیم هیدروکسید بستگی دارد.استنشاق بخارات سدیم هیدروکسید می تواند باعث تحریک مجاری تنفسی، سرفه، عطسه و تنگی نفس شود.تماس سدیم هیدروکسید با پوست می تواند باعث سوختگی شیمیایی شود.تماس سدیم هیدروکسید با چشم می تواند باعث سوختگی شیمیایی چشم شود.بلع سدیم هیدروکسید می تواند باعث تحریک گوارشی، حالت تهوع، استفراغ و اسهال شود.
اثرات مواجهه طولانی مدت سدیم هیدروکسید
استنشاق طولانی مدت بخارات سدیم هیدروکسید می تواند باعث بیماری های ریوی مانند برونشیت مزمن و فیبروز ریوی شود.تماس طولانی مدت سدیم هیدروکسید با پوست می تواند باعث خشکی پوست، درماتیت و سرطان پوست شود.تماس طولانی مدت سدیم هیدروکسید با چشم می تواند باعث آب مروارید، گلوکوم و کوری شود.مواجهه طولانی مدت با سدیم هیدروکسید می تواند باعث آسیب به کبد، کلیه ها و سیستم عصبی شود.
فروش سدیم هیدروکسید، سود پرک دکتر مجللی
فروشگاه ای آز فعال در حوزه فروش اینترنتی مواد شیمیایی آزمایشگاهی و صنعتی و لوازم و تجهیزات آزمایشگاهی است که آماده فروش سدیم هیدروکسید پرک در بسته بندی های مقرون به صرفه و با کیفیت ممتاز در گریدهای صنعتی و آزمایشگاهی و از برندهای معتبر ایرانی، هندی، چینی و اروپایی به پژوهشگران، دانشگاهیان، صنایع و کارخانجات است.

خرید سدیم هیدروکسید، سود پرک دکتر مجللی
جهت خرید سدیم هیدروکسید دکتر مجللی می توانید از بخش "افزودن به سبد خرید" اقدام به ثبت سفارش کالای مورد نظر در وبسایت کنید. از طریق واتس اپ با شماره 09925021003 نیز می توانید کالای مورد نظر را مستقیما از شرکت خریداری کنید.
خطرات سدیم هیدروکسید چیست؟
سدیم هیدروکسید یک ماده شیمیایی خطرناک است و می تواند باعث سوختگی شیمیایی در پوست و چشم شود. بلعیدن سدیم هیدروکسید نیز می تواند سمی باشد.
در صورت تماس با سدیم هیدروکسید چه باید کرد؟
در صورت تماس با پوست: محل تماس را بلافاصله با آب فراوان به مدت 15 تا 20 دقیقه شستشو دهید.
در صورت تماس با چشم: چشم ها را بلافاصله با آب فراوان به مدت 15 تا 20 دقیقه شستشو دهید و به پزشک مراجعه کنید.
در صورت بلع: فوراً به پزشک مراجعه کنید.
آیا سدیم هیدروکسید یک اسید است یا باز؟
سدیم هیدروکسید یک باز قوی است.
چه نوع موادی با سدیم هیدروکسید واکنش می دهند؟
سدیم هیدروکسید با اسیدها، فلزات، برخی از مواد آلی و آب واکنش می دهد.
چگونه می توان غلظت محلول سدیم هیدروکسید را تعیین کرد؟
روش های مختلفی برای تعیین غلظت محلول سدیم هیدروکسید وجود دارد، از جمله تیتراسیون و استفاده از دستگاه pH متر.
چگونه می توان محلول سدیم هیدروکسید را خنثی کرد؟
می توان محلول سدیم هیدروکسید را با اسید خنثی کرد. اسید مناسب برای خنثی سازی به نوع و غلظت NaOH بستگی دارد.
 سدیم هیدروکسید پرک (سود پرک) (دکتر مجللی)
سدیم هیدروکسید پرک (سود پرک) (دکتر مجللی)