با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
اسید نیتریک 65% (دکتر مجللی) Nitric Acid (Extra pure)
بسته بندی: بطری پلاستیکی
کیفیت ممتاز جهت کارهای آزمایشگاهی ، استخراج طلا و..
تضمین اصالت کالا
بازگشت کالا به دلیل "انصراف از خرید" در صورتی مورد قبول است که پلمپ کالا باز نشده باشد.
تاریخچه اسید نیتریک
در قرن شانزدهم به منظور جداسازی طلا از نقره، اسید نیتریک مصرف می شد. این ماده توسط حرارت دادن نمک و سولفات آهن به دست می آمد.تولید صنعتی اسید نیتریک از هوای جوی در سال 1905 توسط فرآیند قوس آغاز شد. این فرآیند بر طبق اکسیداسیون نیتروژن جوی از طریق اکسیژن اتمسفر به اکسید نیتریک با قوس الکتریکی در دمای بسیار بالا اتفاق می افتد.
روش تولید اولیه دیگر توسط مهندس فرانسوی آلبرت نودون در حدود سال 1913 اختراع شد. روش وی اسید نیتریک از الکترولیز نیترات کلسیم را که توسط باکتری ها از مواد نیتروژن دار در ذغال سنگ نارس تبدیل شده است، تولید کرد.
معرفی و کاربرد اسید نیتریک آزمایشگاهی
اسید نیتریک آزمایشگاهی یک اسید قوی با فرمول شیمیایی HNO3 است. به عنوان روح نیتر و آکوا فورتیس نیز شناخته می شود. همانند اسید هیدروکلریک و اسید سولفوریک در صنایع مختلف کاربرد دارد. در شکل خالص خود بی رنگ است اما با گذشت زمان به رنگ زرد تبدیل می شود، این رنگ به دلیل تجزیه اسید نیتریک به اکسیدهای نیتروژن و آب ظاهر می شود. بسیار خورنده و سمی است. تماس با اسید نیتریک آزمایشگاهی باعث سوختگی شدید پوست می شود. با هیدروکسیدها، فلزات و اکسیدها واکنش می دهد و نمک های نیترات را تشکیل می دهد.
HNO3 به عنوان یک عامل اکسید کننده قوی استفاده می شود. می توان آن را با اکسیداسیون کاتالیزوری آمونیاک تولید کرد. این یک معرف رایج مورد استفاده در آزمایشگاه ها و یک ماده شیمیایی مهم است که در صنایع برای تولید مواد منفجره و کودها استفاده می شود. PH اسید نیتریک تقریباً 3.01 است. استفاده از این اسید در استخراج طلا از بردهای الکترونیکی بسیار رایج شده است.
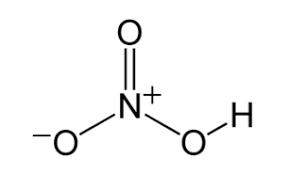
ساختار مولکولی اسید نیتریک
مولکول های اسید نیتریک دارای 3 اتم اکسیژن، 1 اتم نیتروژن و 1 اتم هیدروژن هستند. در مولکول های HNO3، یکی از اتم های اکسیژن به اتم نیتروژن مرکزی پیوند مضاعف دارد. یکی دیگر از اتم های اکسیژن به اتم نیتروژن مرکزی و همچنین به اتم هیدروژن متصل است. آخرین اتم اکسیژن در مولکول اسید نیتریک دارای بار 1- است و به صورت مجزا به اتم نیتروژن مرکزی پیوند دارد. از آنجایی که اتم نیتروژن در مرکز مولکول در چهار پیوند کووالانسی (با 3 اتم اکسیژن) شرکت می کند، دارای بار 1+ است. بنابراین، بار خالص مولکول اسید نیتریک 0 است (بار مثبت اتم نیتروژن و بار منفی اتم اکسیژن یکدیگر را خنثی می کنند). می توان اشاره کرد که بارهای موجود در این مولکول به دلیل رزونانس قابل تغییر موضع هستند. ساختار مولکولی اسید نیتریک آزمایشگاهی در شکل زیر ارائه شده است:
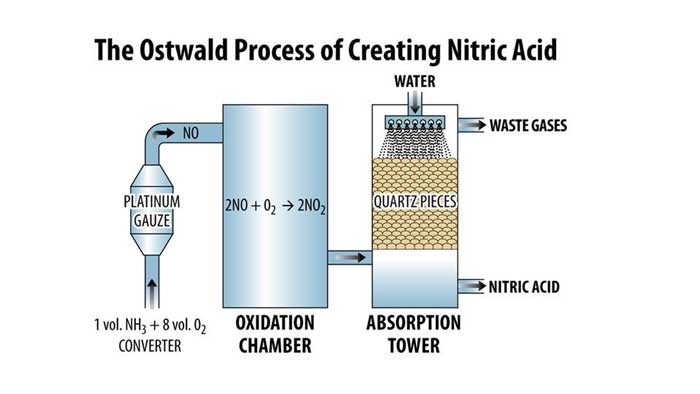
تولید اسید نیتریک
بهترین روش برای تولید اسید نیتریک دکتر مجللی که با هزینه کمی انجام شود و به صورت صنعتی نیز کاربرد داشته باشد، استفاده از آمونیاک به عنوان پیشماده است. در این فرآیند آمونیاک تحت واکنش اکسیداسیون کاتالیکی تهیه میشود. این واکنش در دمایی در حدود 150 تا 170 درجه سانتی گراد انجام میشود. در این روش اسید نیتریک تولید شده غلظتی در حدود 95 درصد دارد. در این روش اسید نیتریک از طریق واکنشهای زیر تولید میشود:
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g)
2 NO (g) + O2 (g) → 2 NO2 (g)
3 NO2 (g) + H2O (l) → 2 HNO3
4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
توضیح فرآیند بالا به این صورت است که گاز آمونیاک در ابتدا اکسید می شود و منجر به تولید نیتریک اکسید و نیتروژن دی اکسید میشود. در ادامه تمامی نیتریک اکسید به دی اکسید نیتروژن تبدیل شده و نیتروژن دی اکسید جذب آب میشود که منجر به شکل گیری اسید نیتریک می شود.
جدول مشخصات فنی اسید نیتریک
| نام ماده | نیتریک اسید |
| فرمول شیمیایی اسید نیتریک | HNO₃ |
| جرم مولکولی | 63.01 g/mol |
| دانسیته | 1.51 g/cm³ |
| نقطه جوش | 83 °C |
| نقطه ذوب | -42 °C |
| pH | 1 |
| شکل ظاهری | مایع بی رنگ مایل به زرد خیلی روشن |
اسامی دیگر اسید نیتریک
- آب قوی
- آب قدرتمند
- تیزاب
- جوهر شوره
موارد استفاده از اسید نیتریک
- برای تولید نیترات آمونیوم برای تولید پلاستیک، رنگ و کود استفاده می شود.
- در ساخت مواد منفجره مانند TNT استفاده می شود.
- در موشک های سوخت مایع به عنوان اکسید کننده استفاده می شود.
- در شکل خالص آن برای از بین بردن زگیل استفاده می شود.
- به عنوان یک عامل دوپینگ شیمیایی در الکتروشیمی استفاده می شود.
دفع ضایعات اسید نیتریک
ماده ریخته شده یا نشت شده را در ظروف بدون منفذ جمع آوری کنید. باقیمانده را با مقدار زیاد آب به بیرون برانید.
انبار کردن و جابه جایی اسید نیتریک
در مکان های مقاوم در برابر آتش سوزی نگهداری شود. از تماس با مواد احیا کننده ومواد آلی اجتناب کنید. نگهداری این مواد در تانکرهای فلزی خطرناک است چون موجب خوردگی سطوح فلزی می شود. برای نگهداری وذخیره این مواد سطح داخلی تانکرهای فلزی را با پلی اتیلن پوشش می دهند. دمای نگهداری آنها بالاتر از 23 درجه نباشد.
نکات ایمنی، شرایط استفاده و نگهداری اسید نیتریک
یک ماده بشدت خورنده است. موجب خوردگی فلزات می شود. با مواد احیا کننده بشدت واکنش می دهد. با فلزاتی هم چون روی و مس بشدت واکنش می دهد. هم چنین با مواد غیر فلزی همچون کربن نیز واکنش می دهد.
- شرایط نگهداری: این ماده را با درب بسته در مکان دور از آفتاب، در زیر هود آزمایشگاهی نگهداری کنید.
- این ماده بسیار سمی، خطرناک و خورنده است.
- پوشیدن عینک آزمایشگاهی، دستکش (آزمایشگاهی-ایمنی) و ماسک فیلتردار (ویژه مواد شیمیایی) الزامیست.
- از آشامیدن یا بلعیدن، تماس با پوست و استنشاق آن خودداری کنید.
- در زیر هود آزمایشگاهی استفاده شود.
- به علت ماهیت شیمیایی کالا، خریدار موظف است کلیه دستورالعمل های استعمال مربوطه را مطالعه و با اطلاع کافی به خطرات احتمالی آن را خریداری کند.
اثرات مواجهه کوتاه مدت
- درصورت تماس با چشم موجب آسیب به غشا می شود.
- موجب تحریک مخاط می شود.
- در صورت تماس باپوست موجب سوختگی شدید در پوست می شود.
اثرات مواجهه طولانی مدت
- سوزش شدید دستگاه تنفسی، سرفه یا تنگی نفس می شود.
- در معرض قرار گرفتن بیش از حد با این اسید حتی موجب مرگ نیز می گردد.
- موجب التهاب چشم، قرمزی چشم وتاول زدگی در پوست می گردد.
بازار جهانی اسید نیتریک
حجم بازار جهانی اسید نیتریک در سال 2023، حدود 28.5 میلیارد دلار بوده است. این بازار انتظار می رود تا سال 2028، با نرخ رشد سالانه ترکیبی (CAGR) 4.5 درصد، به 37.4 میلیارد دلار برسد.
چین، ایالات متحده، و هند، سه کشور پیشرو در تولید اسید نیتریک در جهان هستند. این سه کشور در مجموع، حدود 60 درصد از تولید جهانی اسید نیتریک را به خود اختصاص می دهند.همچنین چین، ایالات متحده، و هند، سه کشور پیشرو در مصرف اسید نیتریک در جهان هستند. این سه کشور در مجموع، حدود 50 درصد از مصرف جهانی اسید نیتریک را به خود اختصاص می دهند.
انتظار می رود بازار جهانی اسید نیتریک در سال های آینده، با نرخ رشد مناسبی رشد کند. این رشد به دلیل عوامل مختلفی، مانند افزایش تقاضا از صنایع مختلف، و توسعه فناوری های جدید، پیش بینی می شود.

فروش اسید نیتریک آزمایشگاهی دکتر مجللی
فروشگاه ای آز فعال در حوزه فروش اینترنتی مواد شیمیایی آزمایشگاهی و صنعتی و لوازم و تجهیزات آزمایشگاهی است که آماده فروش اسید نیتریک دکتر مجللی در بسته بندی های مقرون به صرفه و با کیفیت ممتاز در گریدهای صنعتی و آزمایشگاهی و از برندهای معتبر ایرانی، هندی، چینی و اروپایی به پژوهشگران، دانشگاهیان، صنایع و کارخانجات است.
خرید اسید نیتریک آزمایشگاهی دکتر مجللی
کاربر موظف است پیش از اقدام به خرید این کالا، صفحه قوانین و مقررات وبسایت را مطالعه کند. جهت خرید اسید نیتریک آزمایشگاهی دکتر مجللی می توانید از بخش "افزودن به سبد خرید" اقدام به ثبت سفارش کالای مورد نظر در وبسایت کنید. از طریق واتس اپ با شماره 09925021003 نیز می توانید کالای مورد نظر را مستقیما از شرکت خریداری کنید.
اسید نیتریک چه فلزاتی را حل می کند؟
اسید نیتریک یک اسید قوی است که می تواند با بسیاری از فلزات واکنش دهد. فلزاتی که با اسید نیتریک واکنش می دهند، فلزاتی هستند که در سری فعالیت فلزات در زیر طلا قرار دارند.
1*فلزات قلیایی و قلیایی خاکی، مانند سدیم، پتاسیم، کلسیم و منیزیم
2*فلزات گروه 11، مانند روی و سرب
3*فلزات گروه 12، مانند مس، نقره و طلا
چگونه می توان اسید نیتریک را از اسید هیدروکلریک تشخیص داد؟
برای این کار نیاز به یک تکه روزنامه می باشد. یک قطره از اسید نیتریک را بر روی روزنامه بریزید رنگ آن قرمز می شود. اگر اسید هیدروکلریک بریزید رنگ روزنامه سبز خواهد شد.
آیا بی کربنات سدیم اسید نیتریک را خنثی می کند؟
بی کربنات سدیم یک باز ضعیف است و اسید نیتریک یک اسید قوی است. هنگامی که این دو ماده با هم مخلوط می شوند، یک واکنش خنثی سازی رخ می دهد و یک نمک و آب تولید می شود.برای خنثی کردن یک قسمت از اسید نیتریک، به یک قسمت بی کربنات سدیم نیاز است.
نحوه نگهداری اسید نیتریک 65% چگونه است؟
اسید نیتریک 65% باید در ظروف مخصوص نگهداری شود که در برابر خوردگی مقاوم هستند. این ظروف باید در محلی دور از مواد قابل اشتعال و قابل احتراق نگهداری شوند.
قیمت اسید نیتریک 65% دکتر مجللی چقدر است؟
با توجه به نوسانات ارز و ظرفیت تولید مصرف متغیر در بازار ،قیمت آن متغیر می باشد.
چگونه اسید نیتریک 65% را خنثی کنیم؟
برای خنثی کردن اسید نیتریک، می توان از یک باز قوی، مانند سدیم هیدروکسید یا پتاسیم هیدروکسید، استفاده کرد. این واکنش به صورت زیر است:
همچنین، می توان از یک نمک مضاعف، مانند سدیم نیترات، برای خنثی کردن اسید نیتریک استفاده کرد. این واکنش به صورت زیر است:
آیا اسید نیتریک سمی است؟
بله، اسید نیتریک یک ماده شیمیایی سمی است. استنشاق، بلعیدن یا تماس پوستی با اسید نیتریک می تواند باعث آسیب جدی به سلامتی شود.
 اسید نیتریک 65% (دکتر مجللی)
اسید نیتریک 65% (دکتر مجللی)