با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد

اسید نیتریک 65% (کیان کاوه آزما) Nitric Acid (Extra pure)
کیفیت درجه یک، قیمت رقابتی
بسته بندی: بطری پلاستیکی
نام های مترادف: هیدروژن نیترات
این ماده بسیار سمی، خطرناک و خورنده است. پوشیدن عینک آزمایشگاهی، دستکش (آزمایشگاهی-ایمنی) و ماسک فیلتردار (ویژه مواد شیمیایی) الزامیست. از آشامیدن، تماس با پوست و استنشاق آن خودداری کنید.
بازگشت کالا به دلیل "انصراف از خرید" در صورتی مورد قبول است که پلمپ کالا باز نشده باشد.
معرفی اسید نیتریک آزمایشگاهی
اسید نیتریک آزمایشگاهی یک اسید قوی با فرمول شیمیایی HNO3 است. به عنوان روح نیتر و آکوا فورتیس نیز شناخته می شود. همانند اسید هیدروکلریک و اسید سولفوریک در صنایع مختلف کاربرد دارد. در شکل خالص خود بی رنگ است اما با گذشت زمان به رنگ زرد تبدیل می شود، این رنگ به دلیل تجزیه اسید نیتریک به اکسیدهای نیتروژن و آب ظاهر می شود. بسیار خورنده و سمی است. تماس با اسید نیتریک آزمایشگاهی باعث سوختگی شدید پوست می شود. با هیدروکسیدها، فلزات و اکسیدها واکنش می دهد و نمک های نیترات را تشکیل می دهد.
HNO3 به عنوان یک عامل اکسید کننده قوی استفاده می شود. می توان آن را با اکسیداسیون کاتالیزوری آمونیاک تولید کرد. این یک معرف رایج مورد استفاده در آزمایشگاه ها و یک ماده شیمیایی مهم است که در صنایع برای تولید مواد منفجره و کودها استفاده می شود. PH اسید نیتریک تقریباً 3.01 است. استفاده از این اسید در استخراج طلا از بردهای الکترونیکی بسیار رایج شده است.
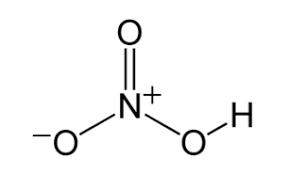
ساختار مولکولی اسید نیتریک
مولکول های اسید نیتریک دارای 3 اتم اکسیژن، 1 اتم نیتروژن و 1 اتم هیدروژن هستند. در مولکول های HNO3، یکی از اتم های اکسیژن به اتم نیتروژن مرکزی پیوند مضاعف دارد. یکی دیگر از اتم های اکسیژن به اتم نیتروژن مرکزی و همچنین به اتم هیدروژن متصل است. آخرین اتم اکسیژن در مولکول اسید نیتریک دارای بار 1- است و به صورت مجزا به اتم نیتروژن مرکزی پیوند دارد. از آنجایی که اتم نیتروژن در مرکز مولکول در چهار پیوند کووالانسی (با 3 اتم اکسیژن) شرکت می کند، دارای بار 1+ است. بنابراین، بار خالص مولکول اسید نیتریک 0 است (بار مثبت اتم نیتروژن و بار منفی اتم اکسیژن یکدیگر را خنثی می کنند). می توان اشاره کرد که بارهای موجود در این مولکول به دلیل رزونانس قابل تغییر موضع هستند. ساختار مولکولی اسید نیتریک آزمایشگاهی در شکل زیر ارائه شده است:
تاریخچه و پیشینه کشف اسید نیتریک
اسید نیتریک (HNO₃) از قرن هشتم میلادی توسط کیمیاگران ایرانی و عرب کشف و شناخته شد. جابر بن حیان، دانشمند و کیمیاگر معروف، به عنوان یکی از اولین افرادی که این اسید را تهیه کرده است، شناخته میشود. اسید نیتریک نقش مهمی در تحول شیمیایی و گسترش علم شیمی داشته است.
تولید اسید نیتریک
اسید نیتریک یکی از اسیدهای معدنی قوی و پرکاربرد است که در صنایع مختلف مورد استفاده قرار میگیرد. روشهای مختلفی برای تولید اسید نیتریک وجود دارد اما امروزه روش صنعتی اصلی، اکسیداسیون آمونیاک است.
روش اکسیداسیون آمونیاک (Ostwald process)این روش به افتخار ویلهلم اوستوالد، شیمیدان آلمانی، نامگذاری شده است. در این فرآیند، آمونیاک (NH₃) در چند مرحله به اسید نیتریک تبدیل میشود:
مرحله اول: اکسیداسیون آمونیاک به مونوکسید نیتروژن
آمونیاک در حضور کاتالیزور پلاتین یا پالادیوم با اکسیژن واکنش داده و مونوکسید نیتروژن (NO) تولید میکند.
این واکنش بسیار گرمازا است.
4NH₃ + 5O₂ → 4NO + 6H₂O
مرحله دوم: اکسیداسیون مونوکسید نیتروژن به دیاکسید نیتروژن
مونوکسید نیتروژن تولید شده در مرحله قبل، در مجاورت اکسیژن به دیاکسید نیتروژن (NO₂) تبدیل میشود
.2NO + O₂ → 2NO₂
مرحله سوم: جذب دیاکسید نیتروژن در آب
دیاکسید نیتروژن در آب حل شده و اسید نیتریک و اکسید نیتریک تولید میکند.
3NO₂ + H₂O → 2HNO₃ + NO
نیتریک اکسید تولید شده در این مرحله مجدداً به مرحله دوم بازگردانده شده و در واکنش شرکت میکند.
مرحله چهارم: تقطیر
محلول اسید نیتریک تولید شده، تقطیر میشود تا اسید نیتریک با غلظت بالا به دست آید.
انواع اسید نیتریک
- اسید نیتریک صنعتی
غلظت 50-70 درصد، عمدتاً برای تولید کودها و مواد منفجره استفاده میشود. - اسید نیتریک خالص
غلظت بالاتر از 90 درصد، برای کاربردهای آزمایشگاهی و صنعتی خاص استفاده میشود.
خواص فیزیکی و شیمیایی اسید نیتریک
| خواص | مشخصات |
| فرمول شیمیایی | HNO₃ |
| جرم مولکولی | 63.01 گرم بر مول |
| ظاهر | مایع بیرنگ تا زرد |
| بو | بوی تند و زننده |
| چگالی | 1.51 گرم بر سانتیمتر مکعب (برای اسید نیتریک غلیظ) |
| نقطه جوش | 83 درجه سانتیگراد |
| نقطه ذوب | -42 درجه سانتیگراد |
| pH | کمتر از 1 (محلول آبی) |
| حلپذیری | کاملاً در آب قابل حل |
| ویسکوزیته | 0.75 سانتیپواز در 25 درجه سانتیگراد |
| گرمای ویژه | 2.043 ژول بر گرم بر درجه سانتیگراد |
| نقطه اشتعال | غیرقابل اشتعال، اما اکسید کننده قوی |
| ثابت دیالکتریک | 35.9 در 25 درجه سانتیگراد |
| پایداری شیمیایی | در دما و فشار معمولی پایدار، اما با مواد کاهنده و فلزات واکنش میدهد |
| حلالهای سازگار | اتانول، اتر، اسید سولفوریک |
| خطرات ایمنی | خورنده قوی، اکسید کننده، مضر برای تنفس، تماس با پوست و چشمها خطرناک است |
کاربردهای اسید نیتریک
اسید نیتریک به دلیل خاصیت اکسیدکنندگی قوی و واکنشپذیری بالا، کاربردهای فراوانی دارد از جمله:
- صنعت کود: استفاده گسترده در تولید کودهای نیتروژنه مانند نیترات آمونیوم.
- مواد منفجره: تولید مواد منفجره مانند نیتروگلیسرین و تیانتی.
- صنعت متالورژی: استفاده در تمیز کردن و اچ کردن فلزات.
- صنعت شیمیایی: تولید انواع مختلفی از ترکیبات شیمیایی مانند نیتروآمینها و رنگها.
- آزمایشگاهها: به عنوان یک ماده اسیدی قوی برای آزمایشهای شیمیایی و تجزیه و تحلیل مواد.
- صنعت موشک: اسید نیتریک به عنوان اکسید کننده در برخی از انواع موشکهای سوخت مایع استفاده میشود.
- پزشکی: در برخی موارد، اسید نیتریک رقیق شده برای از بین بردن زگیلهای پوستی استفاده میشود.
- الکتروشیمی: به عنوان یک عامل دوپینگ شیمیایی در الکتروشیمی به کار میرود.
بستهبندی و نگهداری اسید نیتریک
اسید نیتریک باید در ظروف مقاوم به خوردگی و دارای تهویه مناسب نگهداری شود. این ظروف معمولاً از مواد مقاوم به اسید مانند پلیاتیلن یا شیشه ساخته میشوند. نگهداری در مکانهای خشک، خنک و دور از مواد قابل اشتعال و بازها توصیه میشود.
خطرات و نکات ایمنی اسید نیتریک
تماس با اسید نیتریک میتواند باعث آسیبهای جدی به پوست، چشم و دستگاه تنفسی شود و به همین دلیل باید با دقت و تجهیزات ایمنی مناسب با آن کار کرد.خطرات زیر را بدانید و جدی بگیرید:
- خطرات تنفسی: بخارات اسید نیتریک میتوانند به شدت ریهها و دستگاه تنفسی را تحریک کنند.
- خطرات پوستی: تماس با پوست میتواند باعث سوختگیهای شیمیایی شود.
- خطرات چشمی: تماس با چشمها میتواند باعث آسیب جدی شود.
- واکنش با مواد دیگر: اسید نیتریک با بسیاری از مواد شیمیایی واکنش داده و میتواند باعث تولید گازهای سمی یا انفجار شود.
توجه: اسید نیتریک یک ماده شیمیایی خطرناک است و باید با احتیاط کامل با آن برخورد شود. در صورت تماس با پوست یا چشم، بلافاصله با آب فراوان شستشو داده و به پزشک مراجعه کنید.
انبار کردن و جابهجایی اسید نیتریک
____نکات مهم در انبارش اسید نیتریک
- ظروف مقاوم: اسید نیتریک باید در ظروف مقاوم به اسید مانند ظروف شیشهای یا تفلون نگهداری شود. این ظروف باید به خوبی بسته شوند تا از نشت اسید جلوگیری شود.
- جای خنک و خشک: محل نگهداری اسید نیتریک باید خنک و خشک باشد و دور از منابع حرارتی و تابش مستقیم نور خورشید قرار گیرد.
- جدا از مواد ناسازگار: اسید نیتریک را باید دور از مواد قابل احتراق، مواد آلی و سایر مواد شیمیایی ناسازگار نگهداری کرد. این مواد میتوانند با اسید نیتریک واکنشهای شدید و خطرناکی ایجاد کنند.
- تهویه مناسب: محل انبارش باید دارای تهویه مناسب باشد تا از تجمع بخارات اسید جلوگیری شود.
- برچسبگذاری مناسب: ظروف حاوی اسید نیتریک باید به وضوح برچسبگذاری شوند تا نوع ماده شیمیایی، غلظت آن و تاریخ تولید مشخص باشد.
- سیستم اطفاء حریق: در محل انبارش اسید نیتریک باید سیستم اطفاء حریق مناسب نصب شود.
____نکات مهم در جابهجایی اسید نیتریک
- تجهیزات حفاظتی: هنگام جابهجایی اسید نیتریک، استفاده از تجهیزات حفاظتی مانند دستکشهای مقاوم به اسید، عینک ایمنی، روپوش آزمایشگاهی و ماسک ضروری است.
- جابهجایی آرام: ظروف حاوی اسید نیتریک باید با احتیاط و به آرامی جابهجا شوند تا از شکستن آنها جلوگیری شود.
- سطح صاف و پایدار: سطحی که ظروف اسید نیتریک روی آن قرار میگیرند باید صاف و پایدار باشد تا از لغزش و شکستن آنها جلوگیری شود.
- استفاده از جرثقیل یا لیفتراک: برای جابهجایی ظروف بزرگ حاوی اسید نیتریک، باید از جرثقیل یا لیفتراک استفاده شود.
- جلوگیری از ریزش: هنگام جابهجایی، باید مراقب باشید که اسید نیتریک روی زمین یا پوست نریزد. در صورت ریزش، بلافاصله منطقه آلوده را با آب فراوان شستشو دهید.
دفع ضایعات اسید نیتریک:یک چالش زیستمحیطی مهم
اسید نیتریک به دلیل خاصیت خورنده و سمی بودن، یکی از خطرناکترین مواد شیمیایی محسوب میشود. به همین دلیل، دفع ضایعات این ماده باید با دقت و رعایت تمامی استانداردهای زیستمحیطی انجام شود. دفع نادرست اسید نیتریک میتواند عواقب جبرانناپذیری برای محیطزیست و سلامت انسان داشته باشد.بنابراین سعی کنید ماده ریخته شده یا نشت شده را در ظروف بدون منفذ جمع آوری کنید. باقیمانده را با مقدار زیاد آب به بیرون برانید.
معیارهای خرید اسید نیتریک
هنگام خرید اسید نیتریک، توجه به چندین معیار مهم برای اطمینان از کیفیت و ایمنی محصول ضروری است. این معیارها عبارتند از:
1. خلوص اسید
2. غلظت اسید
3. بستهبندی ایمن و مناسب
4. تولیدکننده و برند
5. قیمت
6. شرایط نگهداری مناسب و حمل و نقل ایمن
7. خدمات پس از فروش
اثرات مواجهه کوتاه مدت با اسید نیتریک
مواجهه کوتاهمدت با اسید نیتریک میتواند باعث سوختگیهای شیمیایی شدید پوست، آسیب جدی به چشمها و تحریک دستگاه تنفسی شود. استنشاق بخارات آن ممکن است منجر به سرفه، تنگی نفس، و در موارد شدیدتر ادم ریوی شود. بلعیدن اسید نیتریک میتواند سوختگیهای شدید در دستگاه گوارش ایجاد کند. انجام اقدامات اضطراری فوری در صورت تماس با اسید نیتریک ضروری است.
اثرات مواجهه طولانی مدت با اسید نیتریک
مواجهه طولانیمدت با اسید نیتریک میتواند باعث تحریک مزمن دستگاه تنفسی، مانند سرفه و برونشیت مزمن، آسیبهای پوستی مداوم مانند درماتیت تماسی، و آسیبهای چشمی دائمی شود. همچنین ممکن است منجر به مشکلات دندانی، مانند فرسایش دندانها، و تأثیرات سیستمیک مانند ضعف عمومی بدن و کاهش وزن شود. برخی مطالعات نیز احتمال افزایش خطر ابتلا به سرطان و آسیبهای کبدی و کلیوی را گزارش کردهاند. رعایت نکات ایمنی و پیشگیرانه برای کاهش این خطرات ضروری است.
فروش اسید نیتریک آزمایشگاهی کیان کاوه
فروشگاه ای آز فعال در حوزه فروش اینترنتی مواد شیمیایی آزمایشگاهی و صنعتی و لوازم و تجهیزات آزمایشگاهی است که آماده فروش اسید نیتریک در بسته بندی های مقرون به صرفه و با کیفیت ممتاز در گریدهای صنعتی و آزمایشگاهی و از برندهای معتبر ایرانی، هندی، چینی و اروپایی به پژوهشگران، دانشگاهیان، صنایع و کارخانجات است.
خرید اسید نیتریک آزمایشگاهی کیان کاوه
کاربر موظف است پیش از اقدام به خرید این کالا، صفحه قوانین و مقررات وبسایت را مطالعه کند. جهت خرید اسید نیتریک آزمایشگاهی کیان کاوه می توانید از بخش "افزودن به سبد خرید" اقدام به ثبت سفارش کالای مورد نظر در وبسایت کنید. از طریق واتس اپ با شماره 09925021003 نیز می توانید کالای مورد نظر را مستقیما از شرکت خریداری کنید.
اسید نیتریک چه فلزاتی را حل می کند؟
برخی از فلزات و آلیاژها توسط اسید نیتریک اکسید می شوند. با این حال، وقتی با اسید نیتریک غلیظ برخورد میشود، طلا و پلاتین اکسید نمیشوند و برخی فلزات غیرفعال میشوند. با استفاده از مخلوط اسیدها یا محلول نیتریک رقیق می توان این فلزات را حل کرد.
چگونه می توان اسید نیتریک را از اسید هیدروکلریک تشخیص داد؟
برای این کار نیاز به یک تکه روزنامه می باشد. یک قطره از اسید نیتریک را بر روی روزنامه بریزید رنگ آن قرمز می شود. اگر اسید هیدروکلریک بریزید رنگ روزنامه سبز خواهد شد.
چه چیزی اسید نیتریک را خنثی می کند؟
بی کربنات سدیم اسید نیتریک را خنثی می کند. خنثی کردن یک قسمت از اسید نیتریک به یک قسمت بی کربنات سدیم نیاز دارد.
اسید نیتریک کیان کاوه را از کجا میتوان تهیه کرد؟
اسید نیتریک کیان کاوه را میتوان از نمایندگیهای معتبر، فروشگاههای مواد شیمیایی و یا مستقیماً از شرکت کیان کاوه تهیه کرد.
آیا اسید نیتریک کیان کاوه قابل بازیافت است؟
بله، در برخی موارد اسید نیتریک میتواند بازیافت شود، اما این فرآیند نیاز به تجهیزات و روشهای خاصی دارد و باید توسط افراد متخصص انجام شود.
 اسید نیتریک 65% (کیان کاوه آزما)
اسید نیتریک 65% (کیان کاوه آزما)








