با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد

این محصول گرید صنعتی می باشد(رنگ کالا زرد می باشد)، برای کارهای حساس برندهای آزمایشگاهی را انتخاب نمایید.
ارسال به سراسر کشور
بازگشت کالا به دلیل "انصراف از خرید" در صورتی مورد قبول است که پلمپ کالا باز نشده باشد.
معرفی و کاربرد سولفات آهن II
سولفات آهن (II) 7 آبه، نوع متداول آهن سولفات II هیدراته ست. آهن II سولفات هیدراته به عنوان فراورده جانبی در تولید دی اکسید تیتانیوم، تولید می شود. از کاربرد های آهن II سولفات هیدراته، می توان به کاربرد آن به عنوان تصفیه کننده آب، جبران کمبود آهن خون و آنمی، اشاره کرد. آهن II سولفات به عنوان معرف تحلیلی، به عنوان مواد اولیه برای فریت، به عنوان ماده اولیه برای تولید اکسید آهن مغناطیسی، آهن (III) اکسید و رنگدانه معدنی آبی (رنگ دانه اکسید آهن)، کاتالیزور آهن، ماده ضد عفونی کننده استفاده می شود. همچنین به عنوان معرف کروماتوگرافی نیز می توان از این ماده استفاده کرد. در کشاورزی از آهن II سولفات به عنوان سموم دفع آفات در کشاورزی استفاده می شود.
تاریخچه سولفات آهن II
تاریخچه سولفات آهن(II) به قرن هفتم قبل از میلاد باز می گردد. در آن زمان، این ماده در مصر باستان برای درمان بیماری های مختلف استفاده می شد.
در قرن 13 میلادی، سولفات آهن(II) در اروپا برای تولید رنگ آبی استفاده می شد.
در قرن 17 میلادی، سولفات آهن(II) به عنوان یک ماده ضدعفونی کننده برای ضدعفونی کردن زخم ها و آب استفاده می شد.
در قرن 19 میلادی، سولفات آهن(II) به عنوان یک کود شیمیایی برای تامین آهن مورد نیاز گیاهان استفاده می شد.
در قرن 20 میلادی، سولفات آهن(II) در صنایع مختلف، از جمله صنایع کاغذسازی، صنایع نساجی، و صنایع تولید رنگ استفاده می شد.
ساختار مولکولی سولفات آهن II
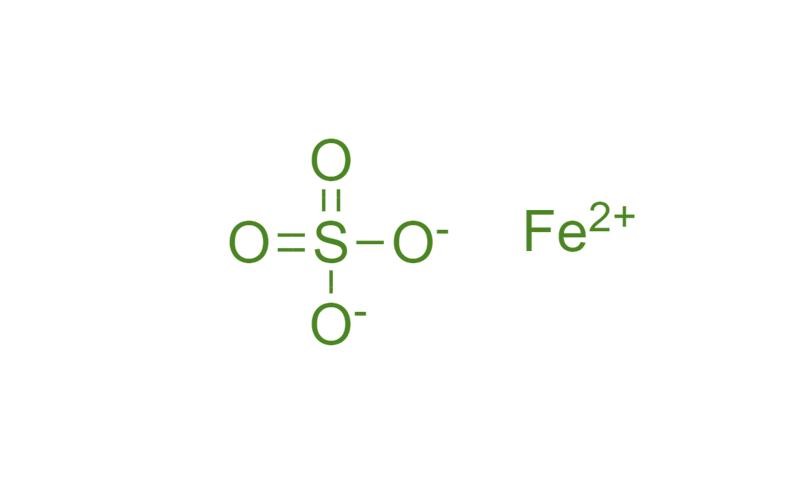
ساختار مولکولی به این صورت است که یون آهن(II) در مرکز قرار دارد و توسط چهار یون سولفات احاطه شده است. یون آهن(II) دارای بار مثبت دو است و یون سولفات دارای بار منفی دو است.
سولفات آهن(II) هپتاهیدرات دارای هفت مولکول آب است که به صورت زیر به یون آهن(II) متصل هستند:در این ساختار، مولکولهای آب در اطراف یون آهن(II) قرار گرفتهاند و به صورت چهاروجهی به آن متصل هستند.
روشهای تولید سولفات آهن II
1.روش اکسیداسیون پیریت:
پیریت یک ماده معدنی حاوی آهن و گوگرد است. این ماده در طبیعت یافت میشود و میتوان از آن برای تولید سولفات آهن استفاده کرد. در این روش، پیریت در معرض هوا قرار میگیرد و با اکسیژن واکنش میدهد. در این واکنش، آهن موجود در پیریت به شکل سولفات آهن تبدیل میشود.
2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4
2.روش اکسیداسیون آهن
آهن نیز میتواند برای تولید سولفات آهن استفاده شود. در این روش، آهن در معرض هوا قرار میگیرد و با اکسیژن واکنش میدهد. در این واکنش، آهن موجود در آهن به شکل سولفات آهن تبدیل میشود.
4Fe + 3O2 + 6H2O → 4FeSO4 + 6H2
3.روش انحلال برادههای آهن در اسید سولفوریک
برادههای آهن نیز میتوانند برای تولید سولفات آهن استفاده شوند. در این روش، برادههای آهن در اسید سولفوریک حل میشوند. در این واکنش، آهن موجود در برادههای آهن به شکل سولفات آهن تبدیل میشود.
Fe + H2SO4 → FeSO4 + H2
اشکال معدنی معروف سولفات آهن II
سولفات آهن(II) در طبیعت به شکل چندین کانی یافت میشود. از جمله کانیهای معروف سولفات آهن(II) میتوان به موارد زیر اشاره کرد:
- میکاسایت (Fe2(SO4)3): این کانی به رنگ سفید تا خاکستری است و به عنوان یک منبع تجاری برای سولفات آهن(II) استفاده میشود.
- فریسپیت (FeSO4): این کانی به رنگ سفید تا سبز است و به عنوان یک کانی فرعی در معادن آهن یافت میشود.
- گویت (FeSO4·7H2O): این کانی به رنگ سبز روشن است و به عنوان یک کانی ثانویه در سنگهای رسوبی یافت میشود
جدول مشخصات فیزیکی و شیمیایی سولفات آهن II
| مشخصه | سولفات آهن(II) |
| فرمول شیمیایی | FeSO4 |
| جرم مولی | 151.91 g/mol |
| ظاهر | جامد بلوری سبز رنگ |
| نقطه ذوب | 100 °C |
| نقطه جوش | 380 °C |
| حلالیت در آب | 138 g/100 mL (20 °C) |
| چگالی | 3.69 g/cm3 |
| pH | 1.8 (محلول 0.1 مولار) |
سولفات آهن(II) هپتاهیدرات یک شکل هیدراته از سولفات آهن(II) است که در آن هفت مولکول آب به هر مولکول سولفات آهن(II) متصل هستند. این ترکیب به صورت جامد بلوری سبز رنگ است و در دمای 60-64 درجه سانتیگراد ذوب میشود. حلالیت سولفات آهن(II) هپتاهیدرات در آب بیشتر از سولفات آهن(II) است.
اسامی سولفات آهن II
در زبان فارسی، با نامهای زیر شناخته میشود:
- زاج سبز یا زاج ترکی: این نام از نام شهر ترکی “زاجوکا” گرفته شده است که در گذشته از این ترکیب برای تولید رنگ استفاده میشده است.
- فروس سولفات یا آهن(II) سولفات: این نام بر اساس ظرفیت اکسیداسیون آهن در این ترکیب که +2 است، انتخاب شده است.
- آهن(II) سولفات هفت آبه یا فریک سولفات هپاتیدرات: این نام بر اساس تعداد مولکولهای آبی که به این ترکیب متصل هستند، انتخاب شده است. در حالت عادی، این ترکیب به صورت هپتاهیدرات یافت میشود و در هر مولکول آن هفت مولکول آب وجود دارد.
نگهداری و بسته بندی سولفات آهن II
سولفات(II) آهن باید در مکانی خشک و خنک و دور از رطوبت و نور مستقیم خورشید نگهداری شود. این ترکیب باید در ظروف در بسته و محکم نگهداری شود تا از تماس با هوا و سایر مواد جلوگیری شود.
این ترکیب در صورت تماس با پوست و چشم میتواند باعث تحریک شود. بنابراین، هنگام کار با سولفات آهن(II) باید از دستکش و عینک ایمنی استفاده شود.
بسته بندی سولفات آهن(II) به صورت کیسههای پلی اتیلن، کیسههای پلی پروپیلن یا بشکههای فلزی است. نوع بسته بندی به مقدار و کاربرد سولفات آهن(II) بستگی دارد.
دفع ضایعات سولفات آهن II
روش های مختلفی برای دفع ضایعات سولفات آهن(II) وجود دارد. از جمله این روش ها می توان به موارد زیر اشاره کرد:
- دفن:ضایعات سولفات آهن(II) را می توان در محل های دفن زباله های شیمیایی دفن کرد. این روش یک روش نسبتاً ارزان است، اما می تواند خطر آلودگی محیط زیست را ایجاد کند.
- سوزاندن:ضایعات سولفات آهن(II) را می توان در کوره های صنعتی سوزانده و به گازهای دی اکسید گوگرد و اکسید آهن تبدیل کرد. این روش یک روش نسبتاً ایمن است، اما می تواند باعث آلودگی هوا شود.
- بازیابی:ضایعات سولفات آهن(II) را می توان بازیابی و دوباره مورد استفاده قرار داد. این روش یک روش ایمن و پایدار است، اما ممکن است هزینه بر باشد.
در صورت عدم وجود امکانات مناسب برای دفع ضایعات سولفات آهن(II)، این ضایعات را باید در ظروف محکم و دربسته نگهداری کرد و دور از دسترس کودکان و حیوانات خانگی قرار داد. در صورت لزوم، می توان از یک شرکت معتبر برای دفع ضایعات سولفات آهن(II) کمک گرفت.
مواردایمنی و خطرات سولفات آهن II
سولفات آهن(II) یک ترکیب شیمیایی نسبتاً ایمن است، اما در صورت تماس با پوست یا چشم میتواند باعث تحریک شود. همچنین، این ترکیب در صورت بلعیده شدن میتواند باعث ناراحتی معده شود.
بازار جهانی سولفات آهن II
بازار جهانی سولفات آهن(II) در حال حاضر رو به رشد است. این امر به دلیل افزایش تقاضا برای این ماده در صنایع مختلف است.انتظار می رود بازار جهانی سولفات آهن(II) در سال های آینده با نرخ رشد سالانه حدود 5 درصد رشد کند. این رشد به دلیل افزایش تقاضا برای این ماده در صنایع مختلف است.
کشورهای چین، هند، و ایالات متحده بزرگترین تولیدکنندگان و مصرف کنندگان سولفات آهن(II) در جهان هستند.
چین بزرگترین تولیدکننده سولفات آهن(II) در جهان است. این کشور در سال 2022 حدود 50 درصد از تولید جهانی سولفات آهن(II) را به خود اختصاص داده است.همچنین چین بزرگترین مصرفکننده سولفات آهن(II) در جهان است. این کشور در سال 2022 حدود 40 درصد از مصرف جهانی سولفات آهن(II) را به خود اختصاص داده است.
دلایل برتری چین در تولید و مصرف سولفات آهن(II):1.منابع فراوان سنگ معدن آهن2.نیروی کار ارزان3.زیرساخت های صنعتی پیشرفته
فروش سولفات آهن II
فروشگاه اینترنتی ای آز فعال در حوزه فروش مواد شیمیایی آزمایشگاهی-صنعتی و ملزومات و تجهیزات آزمایشگاهی-پژوهشی می باشد که آماده فروش سولفات آهن II با بهترین قیمت و کیفیت ممتاز در گرید های مختلف آزمایشگاهی، غذایی و صنعتی از معتبرترین منابع چینی، هندی و اروپایی در بسته بندی های: 5 گرمی، 10 گرمی، 25 گرمی، 50 گرمی، 100 گرمی، 250 گرمی، 500 گرمی، 1 کیلو و 25 کیلویی به پژوهشگران، دانشگاهیان، صنایع و کارخانجات است.
خرید سولفات آهن II
شما می توانید سولفات آهن II را با قیمت مناسب از فروشگاه اینترنتی ای آز در بسته بندی های متنوع تهیه کنید. برای این منظور، از بخش " افزودن به سبد خرید" اقدام به ثبت سفارش کالای مورد نظر بکنید.
سولفات آهن II در درمان و پیشگیری از کم خونی فقر آهن چگونه عمل می کند؟
آهن یک ماده معدنی ضروری برای تولید گلبول های قرمز خون است. کمبود آهن می تواند منجر به کم خونی فقر آهن شود که با علائمی مانند خستگی، رنگ پریدگی، سرگیجه، تنگی نفس و سردرد همراه است.
سولفات آهن II یک منبع آهن قابل جذب است که می تواند برای درمان و پیشگیری از کم خونی فقر آهن استفاده شود. این ماده با جایگزینی آهن از دست رفته در بدن، به تولید گلبول های قرمز خون کمک می کند.
عوارض جانبی سولفات آهن II چیست؟
سولفات آهن II به طور کلی یک ماده بی خطر است، اما ممکن است عوارض جانبی خفیفی مانند حالت تهوع، استفراغ، اسهال، یبوست و یبوست ایجاد کند.
در موارد نادر، سولفات آهن II می تواند عوارض جانبی جدی تری مانند واکنش های آلرژیک، آسیب کبدی و آسیب کلیه ایجاد کند.
سولفات آهن II با آب چگونه واکنش می دهد؟
سولفات آهن II در آب حل می شود و محلول آبی آن به رنگ سبز آبی است.
معادله واکنش:
چه چیزی سولفات آهن II را خنثی می کند؟
سولفات آهن II یک نمک اسیدی است. برای خنثی کردن سولفات آهن II، باید یک باز به آن اضافه کرد. بازها با اسید ها واکنش داده و نمک و آب تولید می کنند.
به عنوان مثال، اگر به محلول سولفات آهن II، محلول هیدروکسید سدیم اضافه کنیم، واکنش زیر رخ می دهد:
در این واکنش، سولفات آهن II با هیدروکسید سدیم واکنش داده و هیدروکسید آهن و سدیم سولفات تولید می کند.
در نتیجه، سولفات آهن II توسط بازها خنثی می شود.
سولفات آهن II را تا چه زمانی می توان نگه داشت؟
سولفات آهن II در صورت نگهداری صحیح، می تواند تا چند سال ماندگاری داشته باشد. ماندگاری سولفات آهن II به عوامل مختلفی از جمله شرایط نگهداری، نوع بسته بندی و درصد خلوص آن بستگی دارد.
 سولفات آهن
سولفات آهن